Diagrama de Tanabe-Sugano
Els diagrames de Tanabe-Sugano s'utilitzen en química de coordinació per predir les absorcions dels compostos de coordinació en les regions de la UV i el visible de l'espectre electromagnètic. Els resultats de l'anàlisi d'un diagrama de Tanabe-Sugano d'un complex metàl·lic també poden ser comparats amb les dades espectroscòpiques experimentals.
Diagrames de Tanabe-Sugano
[modifica]Els set diagrames de Tanabe-Sugano per a complexos octaèdrics es mostren a continuació:
 |
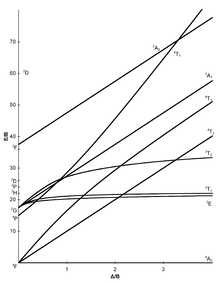 |
 |
 |
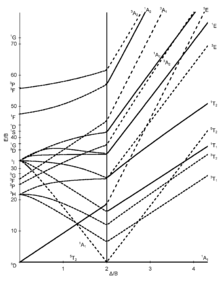 |
 |
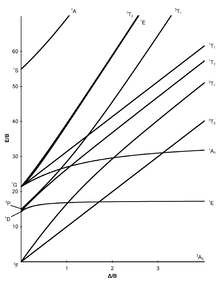 |
Diagrames innecessaris: d¹, d⁹ i d¹⁰
[modifica]d¹
[modifica]En un complex amb configuració d¹ no hi ha repulsió electrònica i l'únic electró es troba a l'estat orbital fonamental t2g. Un complex metàl·lic octaèdric d¹, com el [Ti(H₂O)₆]3+, mostra una única banda d'absorció experimental en UV-Vis. El símbol de terme per d¹ és ²D, que es divideix en els estats T2g i Eg. El conjunt orbital t2g manté l'únic electró i té un estat energètic ²T2g de -4Δ. Quan aquest electró és promocionat a un orbital eg és excitat a l'estat energètic ²Eg, +6Δ. Això correspon a la banda d'absorció senzilla registrada a l'UV-vis. Així, la simple transició de ²T₂ a ²Eg no necessita un diagrama de Tanabe-Sugano.
d⁹
[modifica]De forma similar als complexos metàl·lics d¹, els complexos metàl·lics octaèdrics d⁹ tenen un terme espectroscòpic ²D. La transició és de la configuració (t2g)⁶(eg)3 (estat ²Eg) a la configuració (t2g)⁵(eg)4 (estat ²T2g). Això també pot ser descrit com un buit positiu que es mou del conjunt d'orbitals t2g als eg. El signe de Δ és oposat al de d¹, amb un estat fonamental ²Eg i un estat excitat ²T2g. Igual que en el cas d¹, els complexos octaèdrics d⁹ no requereixen un diagrama de Tanabe-Sugano per predir-ne l'espectre d'absorció.
d¹⁰
[modifica]No hi ha transicions electròniques d-d en complexos metàl·lics d¹⁰, ja que els orbitals d estan completament ocupats. Així doncs, no s'observen bandes d'absorció UV-vis i el diagrama de Tanabe-Sugano no existeix.
